
糖尿病是一组以慢性高血糖为特征的内分泌代谢综合征,可导致大血管和微血管并发症,从而降低患者的生活质量和寿命[1]。当前随着人口老龄化与生活方式的变化,中国成年人中糖尿病的患病率已从2007年的9.7%上升到2017年的11.2%[2]。其中2型糖尿病(T2DM)约占90%~95%[3]。T2DM是由胰岛B细胞分泌胰岛素功能缺陷和(或)胰岛素抵抗引起。传统的降糖药物常需每日多次服用或注射,患者依从性差。
近年来胰高血糖素样肽-1(Glucagon-like peptide-1, GLP-1)受体激动药治疗T2DM逐渐受到关注[4-5]。GLP-1受体激动药其氨基酸序列与内源性GLP-1相似,不仅发挥GLP-1的降血糖效应,还可以避免被二肽基肽酶-4(DPP-4)降解,延长作用时间[6-7]。司美格鲁肽(曾用名:索马鲁肽)是诺和诺德公司研发的一种长效GLP-1受体激动药,于2017年12月获得美国FDA批准上市,主要用于T2DM的治疗。相关研究表明,司美格鲁肽可使T2DM患者血糖水平大幅改善,且毒副作用较小[8-9],具有广泛的临床应用前景。前期虽有作者已整理发表综述[9-12],但多个司美格鲁肽临床研究后续相继发表[13-15],有必要再整理司美格鲁肽相关研究进展。为此,笔者以“司美格鲁肽”“索马鲁肽”“糖尿病”“胰高血糖素样肽-1”“Semaglutide”“diabetes”“Glucagon-Like Peptide-1”“GLP-1”等为关键词,检索至2020年5月在中国知网、万方数据、PubMed等数据库中的相关献。结果,共检索到相关文献406篇,其中有效文献29篇。现对司美格鲁肽的分子结构和作用机制、药代动力学特征及临床试验数据进行了概括,并重点对有效性安全性进行综述,以期为医患合理使用新型长效GLP-1受体激动药司美格鲁肽提供参考。
司美格鲁肽为GLP-1类似物,可选择性结合并激活GLP-1受体,其肽链与人GLP-1具有94%的序列同源性。从分子结构可以发现通过棕榈酸的疏水性自缔结成为七聚体,减缓了皮下注射部位的吸收;同时吸收入血后与血浆白蛋白结合增加,形成缓慢释放的储库,使体内吸收与分布时间延长,半衰期较天然GLP-1受体激动药显著延长;另外由于GLP-1(7-37)链上8位的丙氨酸取代为α-氨基异丁酸,34位的精氨酸取代了赖氨酸,26位的赖氨酸位置连接上十八烷酸脂肪链,又经过短链的聚乙二醇(PEG) 修饰,亲水性大大增强,不但可以与白蛋白紧密结合,掩盖DPP-4水解位点,还能降低肾排泄,显著延长半衰期至约1周,适合每周一次皮下注射,达到长循环的效果[10-11]。
临床试验显示[9-12],司美格鲁肽可通过多种机制发挥临床作用:
(1)改善B细胞应答,促进1相和2相胰岛素分泌;
(2)抑制胰高糖素分泌,但低血糖时不再抑制其分泌[16];
(3)抑制食欲,减少能量摄入;
(4)延缓胃排空。

司美格鲁肽药代动力学特征总结如下:
吸收:注射后1~3天达到Cmax,每周一次给药4~5周后,体内药物暴露水平达到稳态,皮下给药的绝对生物利用度为89%[12];
分布:T2DM患者皮下给药后平均分布容积约为12.5 L,司美格鲁肽可与血浆白蛋白广泛结合(>99%);
代谢:经过肽骨架的蛋白酶剪切和脂肪酸侧链的序贯β氧化而广泛代谢,中性内切酶可能参与其代谢;
消除:约2/3的司美格鲁肽相关物质经尿液排泄,约1/3经粪便排泄,约3%的司美格鲁肽以原形经尿液排泄[17-18]。
已有文献分析了特殊人群对司美格鲁肽药代动力学特征的影响,如糖尿病易合并肾功能受损,Marbury TC等通过纳入56名18~75岁不同肾功能状态的受试者,予司美格鲁肽0.5 mg 单次皮下注射后检测血药浓度变化,校正年龄、性别等因素后,发现肾功能受损对索马鲁肽的药代动力学参数无显著影响[18]。又如很多药物代谢动力学受肝功能影响,Jensen L等研究根据Child-Pugh评分纳入不同肝功能状态受试者,予司美格鲁肽0.5 mg单次皮下注射后检测血药浓度变化,结果显示肝功能受损对司美格鲁肽的药代动力学参数亦无影响[19]。
而一项单中心、随机双盲、平行对照临床试验探讨了种族对药代动力学特征的影响,44名健康男性随机接受司美格鲁肽起始剂量为0.5 mg或1.0 mg每周一次皮下注射治疗(剂量可增加),结果司美格鲁肽药代动力学特征不因种族而改变,其稳态期AUC 0-168h无显著差异[20]。1 612例次的日本人群血药浓度数据研究,同样显示司美格鲁肽平均血药浓度不受年龄、性别、种族、注射部位等因素影响[21-22]。
SUSTAIN (Semaglutide Unabated Sustainability in Treatment of Type 2 Diabetes)系列研究是司美格鲁肽的3期临床研究,在T2DM人群中对司美格鲁肽的疗效及安全性、心血管和肾脏结局等进行了全面的评估,对照组分别为未用药、单种口服降糖药、多种口服降糖药或胰岛素。
SUSTAIN 1为一项随机、双盲、平行、安慰剂对照的多中心研究[23],该研究共纳入388例糖尿病患者,随机分组后分别给予司美格鲁肽0.5 mg和1.0 mg或等量安慰剂皮下注射,30周后司美格鲁肽治疗组HbA1c分别降低1. 45%和1.55%,而安慰剂组仅下降0.02%(两组P<0.000 1)。0.5 mg及1.0 mg给药组体重分别降低3.73 kg和4.53 kg,而安慰剂组仅降低0.98 kg(两组P<0.000 1)。显示其良好的改善HbA1c和减轻体重作用。SUSTAIN 5同样是一项T2DM患者安慰剂对照研究,通过司美格鲁肽或安慰剂分别联合基础胰岛素(或胰岛素+二甲双胍)治疗的患者对比,评估司美格鲁肽的有效性[24],结果显示,30周干预后司美格鲁肽0.5 mg组及1.0 mg组的平均 HbA1c水平分别下降1.4%和1.8%,体质量分别减轻3.7 kg和6.4 kg,而对照组平均 HbA1c水平仅降低 0.1%,体质量减轻1.4 kg。而SUSTAIN 9则是针对葡萄糖转运蛋白-2(SGLT-2)抑制剂基础上分别给予司美格鲁肽或安慰剂的研究,纳入的研究对象为SGLT-2抑制剂治疗90天但仍HbA1c>7.0%的T2DM患者[14],同样观察30周后,司美格鲁肽组的HbA1c下降较安慰剂组多1.42%;且体重较安慰组多降低3.81 kg。
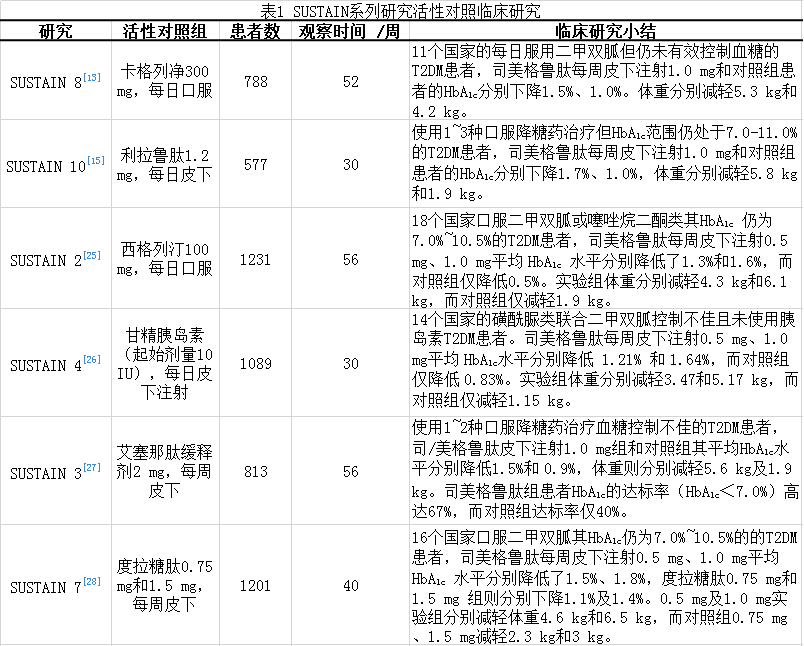
另有6项SUSTAIN临床研究探讨了司美格鲁肽与活性对照药物的临床疗效和对患者体重的影响[13,15,25-28](具体见表1),活性对照药分别包括其他GLP-1受体激动药如度拉糖肽、利拉鲁肽及艾塞那肽周制剂、甘精胰岛素、DPP-4抑制剂西格列汀和SGLT-2抑制剂卡格列净,结果显示,司美格鲁肽降低HbA1c疗效显著优于其他对照组,司美格鲁肽1.0 mg降HbA1c最高达1.8%。另一方面,司美格鲁肽减重疗效亦显著优于其他任何对照组,其1.0 mg减重最高达6.5kg。
司美格鲁肽的安全性数据主要来源于SUSTAIN研究中的3期临床试验,共纳入了10项国际多中心临床试验[13-15,23-29]和2项日本临床试验[21-22]。司美格鲁肽在一系列临床试验中均显示了较好的安全性和耐受性,研究结果显示司美格鲁肽与其他对照组总体不良事件和严重不良事件发生率类似,最常见的不良事件为胃肠道反应,且可以随着用药时间延长而消失。其中轻中度、一过性恶心是其最常见的胃肠道不良事件,恶心的发生率较安慰剂组升高,但与其他GLP-1类似物发生率相似。0.5 mg和1.0 mg司美格鲁肽出现恶心不良反应的发生率分别为20%和24%,安慰剂组的发生率为8%;腹泻(13%和11% vs 2%),头痛(12%和7% vs 6%),消化不良(5%和4% vs 2%),呕吐(4%和7% vs 2%)、便秘(6%和4% vs <1%)等。
在SUSTAIN系列临床试验中,SUSTAIN 6为一项旨在评估司美格鲁肽对T2DM患者心血管功能影响的随机、双盲研究[29]。该研究共纳入3 297例具有心血管高危风险的T2DM患者,持续时间长达104周。结果显示,司美格鲁肽治疗的患者和安慰剂治疗的患者发生非致死性心肌梗塞的概率分别为2.9%和3.9%;非致命性卒中的发生率分别为1.6%和2.7%。两组间心血管原因导致的死亡率相似。司美格鲁肽组肾病新发或恶化的发生率较低,但视网膜病变并发症的发生率明显较高(HR:1.76; 95%CI:1.11-2.78; P=0.02)。司美格鲁肽组发生的严重不良事件较少,但有更多患者因胃肠道不良反应而停止治疗。上述结果显示,与接受传统降糖药的患者相比,心血管高危风险的T2DM患者接受司美格鲁肽治疗可以显著降低心血管死亡、非致死性心肌梗塞或非致命性卒中所组成的主要复合终点事件发生率。

[1] DAVIES MJ, D'ALESSIO DA, FRADKIN J, et al. Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD) [J]. Diabetes Care, 2018,41(12):2669-2701.
[2] LI Y, TENG D, SHI X, et al. Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association: national cross sectional study [J]. BMJ, 2020,369:m997.
[3] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2017年版) [J]. 中华糖尿病杂志, 2018, 10(1): 4-67.
[4] MUSKIET MHA, TONNEIJCK L, SMITS MM, et al. GLP-1 and the kidney: from physiology to pharmacology and outcomes in diabetes [J]. Nat Rev Nephrol, 2017,13(10):605-628.
[5] SPOSITO AC, BERWANGER O, DE CARVALHO LSF, et al. GLP-1RAs in type 2 diabetes: mechanisms that underlie cardiovascular effects and overview of cardiovascular outcome data [J]. Cardiovasc Diabetol,2018,17(1):157.
[6] LAU J, BLOCH P, SCHÄFFER L, et al. Discovery of the Once-Weekly Glucagon-Like Peptide-1 (GLP-1) Analogue Semaglutide [J]. J Med Chem, 2015,58(18):7370-7380.
[7] NAUCK MA, MEIER JJ, CAVENDER MA, et al. Cardiovascular Actions and Clinical Outcomes With Glucagon-Like Peptide-1 Receptor Agonists and Dipeptidyl Peptidase-4 Inhibitors [J]. Circulation, 2017,136(9):849-870.
[8] HALL S, ISAACS D, CLEMENTS JN. Pharmacokinetics and Clinical Implications of Semaglutide: A New Glucagon-Like Peptide (GLP)-1 Receptor Agonist [J]. Clin Pharmacokinet, 2018,57(12):1529-1538.
[9] 杨婷, 李明莎, 王治坤. 皮下注射索马鲁肽治疗2型糖尿病有效性和安全性的Meta分析 [J]. 中国药房, 2018, 29(20): 2856-2861.
[10] 张新丽, 丁发明, 尹茂山. 新型胰高血糖素样肽-1类似物-索马鲁肽 [J]. 中国临床药理学杂志, 2018, 34(20): 2456-2460.
[11] 林旋, 王俊玲, 李泰明, 等. 长效胰高血糖素样肽-1受体激动剂的研究进展 [J]. 中国新药杂志, 2015, 24(15): 1735-1741.
[12] 张恩景, 李玉萍. 长效胰高血糖素样肽-1受体激动剂索马鲁肽 [J]. 中南药学, 2018, 16(6): 817-820.
[13] LINGVAY I, CATARIG AM, FRIAS JP, et al. Efficacy and safety of once-weekly semaglutide versus daily canagliflozin as add-on to metformin in patients with type 2 diabetes (SUSTAIN 8): a double-blind, phase 3b, randomised controlled trial [J]. Lancet Diabetes Endocrinol, 2019,7(11):834-844.
[14] ZINMAN B, BHOSEKAR V, BUSCH R, et al. Semaglutide once weekly as add-on to SGLT-2 inhibitor therapy in type 2 diabetes (SUSTAIN 9): a randomised, placebo-controlled trial [J]. Lancet Diabetes Endocrinol, 2019,7(5):356-367.
[15] CAPEHORN MS, CATARIG AM, FURBERG JK, et al. Efficacy and safety of once-weekly semaglutide 1.0 mg vs once-daily liraglutide 1.2 mg as add-on to 1-3 oral antidiabetic drugs in subjects with type 2 diabetes (SUSTAIN 10) [J]. Diabetes Metab, 2020,46(2):100-109.
[16] DRUCKER DJ. Mechanisms of Action and Therapeutic Application of Glucagon-like Peptide-1 [J]. Cell Metab, 2018,27(4):740-756.
[17] JENSEN L, HELLEBERG H, ROFFEL A, et al. Absorption, metabolism and excretion of the GLP-1 analogue semaglutide in humans and nonclinical species [J]. Eur J Pharm Sci, 2017, 104:31-41.
[18] MARBURY TC, FLINT A, JACOBSEN JB, et al. Pharmacokinetics and Tolerability of a Single Dose of Semaglutide, a Human Glucagon-Like Peptide-1 Analog, in Subjects With and Without Renal Impairment [J]. Clin Pharmacokinet, 2017,56(11):1381-1390.
[19] JENSEN L, KUPCOVA V, AROLD G, et al. Pharmacokinetics and tolerability of semaglutide in people with hepatic impairment [J]. Diabetes Obes Metab, 2018,20(4):998-1005.
[20] IKUSHIMA I, JENSEN L, FLINT A, ,et al. A Randomized Trial Investigating the Pharmacokinetics, Pharmacodynamics, and Safety of Subcutaneous Semaglutide Once-Weekly in Healthy Male Japanese and Caucasian Subjects [J]. Adv Ther, 2018,35(4):531-544.
[21] SEINO Y, TERAUCHI Y, OSONOI T, et al. Safety and efficacy of semaglutide once weekly vs sitagliptin once daily, both as monotherapy in Japanese people with type 2 diabetes [J]. Diabetes Obes Metab, 2018,20(2):378-388.
[22] KAKU K, YAMADA Y, WATADA H, et al. Safety and efficacy of once-weekly semaglutide vs additional oral antidiabetic drugs in Japanese people with inadequately controlled type 2 diabetes: A randomized trial [J]. Diabetes Obes Metab, 2018,20(5):1202-1212.
[23] SORLI C, HARASHIMA SI, TSOUKAS GM, et al. Efficacy and safety of once-weekly semaglutide monotherapy versus placebo in patients with type 2 diabetes (SUSTAIN 1): a double-blind, randomised, placebo-controlled, parallel-group, multinational, multicentre phase 3a trial [J]. Lancet Diabetes Endocrinol, 2017,5(4):251-260.
[24] RODBARD HW, LINGVAY I, REED J, et al. Semaglutide Added to Basal Insulin in Type 2 Diabetes (SUSTAIN 5): A Randomized, Controlled Trial [J]. J Clin Endocrinol Metab, 2018,103(6):2291-2301.
[25] AHRÉN B, MASMIQUEL L, KUMAR H, et al. Efficacy and safety of once-weekly semaglutide versus once-daily sitagliptin as an add-on to metformin, thiazolidinediones, or both, in patients with type 2 diabetes (SUSTAIN 2): a 56-week, double-blind, phase 3a, randomised trial [J]. Lancet Diabetes Endocrinol, 2017,5(5):341-354.
[26] ARODA VR, BAIN SC, CARIOU B, et al. Efficacy and safety of once-weekly semaglutide versus once-daily insulin glargine as add-on to metformin (with or without sulfonylureas) in insulin-naive patients with type 2 diabetes (SUSTAIN 4): a randomised, open-label, parallel-group, multicentre, multinational, phase 3a trial [J]. Lancet Diabetes Endocrinol, 2017,5(5):355-366.
[27] AHMANN AJ, CAPEHORN M, CHARPENTIER G, et al. Efficacy and Safety of Once-Weekly Semaglutide Versus Exenatide ER in Subjects With Type 2 Diabetes (SUSTAIN 3): A 56-Week, Open-Label, Randomized Clinical Trial [J]. Diabetes Care, 2018,41(2):258-266.
[28] PRATLEY RE, ARODA VR, LINGVAY I, et al. Semaglutide versus dulaglutide once weekly in patients with type 2 diabetes (SUSTAIN 7): a randomised, open-label, phase 3b trial [J]. Lancet Diabetes Endocrinol, 2018,6(4):275-286.
[29] MARSO SP, BAIN SC, CONSOLI A, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes [J]. N Engl J Med, 2016,375(19):1834-1844.
张佳丽,女,硕士,毕业于浙江大学药学院;浙江大学医学院附属第二医院ICU专业临床药师,中华医学会临床药学分会ICU专业带教药师。主持浙江省自然科学基金1项,浙江省卫生厅课题1项,浙江省药学会课题1项,已发表SCI论文5篇,核心期刊2篇。邮箱:zjlsally@zju.edu.cn
杨建苗 浙江省台州医院药师。
许东航,男,博士,主任药师,浙江大学硕士生导师,现为《中国药房》等多个杂志编委。主要从事药物的控制与释放、分子药剂学和医院药学领域研究工作。主持、主参多个国家、省自然科学基金项目;发表论文110余篇,其中以第一或通讯作者发表SCI论文10余篇,最高影响因子4.4;申请获批专利一项;获中华医学会医学科普奖1次,浙江省医药科技奖2次。邮箱:xudonghang@zju.edu.cn